醫(yī)療器械注冊人制度
- 立即咨詢
-
全國服務熱線:
400-888-7587

400-888-7587
? 簡介 / Introduction to the
?醫(yī)療器械注冊人制度,是指符合條件的醫(yī)療器械注冊申請人可以單獨申請醫(yī)療器械注冊證,然后委托給有資質和生產(chǎn)能力的生產(chǎn)企業(yè)生產(chǎn),從而實現(xiàn)醫(yī)療器械產(chǎn)品注冊證和生產(chǎn)許可證的“解綁”。醫(yī)療器械注冊人制度撬動了醫(yī)療器械行業(yè)的顛覆性變革。北京、天津、河北、遼寧、黑龍江、上海、江蘇、浙江、安徽、福建、山東、河南、湖北、湖南、廣東、廣西、海南、重慶、四川、云南、陜西等21個省、自治區(qū)、直轄市參加醫(yī)療器械注冊人制度試點。
? 注冊人制度歷年政策 / Registrant system calendar year policy
?2015年8月,國務院發(fā)布《關于改革藥品醫(yī)療器械審評審批制度的意見》,提出推進藥品上市許可人制度。同年11月,全國人大常委會授權國務院在北京、天津、河北、上海、江蘇、浙江、福建、山東、廣東、四川10個省市開展藥品上市許可持有人制度試點。以藥品上市許可持有人制度試點為突破口,拉開了藥品注冊制度改革的帷幕。藥品注冊制度將由上市許可與生產(chǎn)許可的“捆綁制”,向上市許可與生產(chǎn)許可分離的“上市許可持有人制度”轉型。藥品上市許可持有人節(jié)約了藥品創(chuàng)新成本,縮短藥品上市周期,增加了科研預期收益,還減少了重復建設,優(yōu)化資源配置,推動專業(yè)化分工。
?2016年6月,國務院辦公廳發(fā)布《關于印發(fā)藥品上市許可持有人制度試點方案的通知》,明確試點內容、試點品種范圍、持有人條件、持有人義務與責任等。制度實施以來,收效頗豐。國家食藥監(jiān)總局相關負責人在首屆藥物政策與產(chǎn)業(yè)創(chuàng)新發(fā)展論壇上介紹說,自我國正式啟動藥品上市許可持有人制度試點,截至2017年10月,10個試點省市共受理試點藥品品種各類申請560件,監(jiān)管對象從側重企業(yè)轉為側重產(chǎn)品(經(jīng)濟參考報)。
?藥品上市許可人制度的成功,讓醫(yī)療器械人看到了希望。一直以來,獲證周期長、資金投入高、資源閑置浪費、法規(guī)解讀不全面、設計轉換難度大等已成為醫(yī)療器械創(chuàng)業(yè)者的共同難題,也在一定程度上掣肘我國醫(yī)療器械行業(yè)的發(fā)展。“如出一轍”的行業(yè)背景讓醫(yī)療器械人堅信:效仿“藥品上市許可持有人制度”是醫(yī)療器械行業(yè)尋求發(fā)展的不二之選。
?2017年12月7日,上海食品藥品監(jiān)督管理局發(fā)布并實施了《中國(上海)自由貿(mào)易試驗區(qū)內醫(yī)療器械注冊人制度試點工作實施方案》,標志著醫(yī)療器械注冊人制度正式出臺。醫(yī)療器械行業(yè)自此實現(xiàn)了解綁,生產(chǎn)方和技術方分離。醫(yī)療器械注冊申請人可以是醫(yī)療器械生產(chǎn)企業(yè)(包括集團公司),也可以是研發(fā)機構、科研人員、醫(yī)生等。醫(yī)療器械注冊人制度使上市許可持有人不用再背負生產(chǎn)設備、人員、場地等資產(chǎn)運營壓力,使其專注于產(chǎn)品研發(fā),有利于激發(fā)醫(yī)療器械創(chuàng)新人才的積極性,同時將生產(chǎn)委托給有資質和生產(chǎn)能力的企業(yè)完成,這種分工能有效抑制醫(yī)療器械行業(yè)的低水平重復建設,也將加快創(chuàng)新產(chǎn)品的上市和落地。
?2018年8月16日,國家食品藥品監(jiān)督管理總局批復同意《廣東省醫(yī)療器械注冊人制度試點工作方案》,標志著即日起廣東省 “醫(yī)療器械注冊人制度”正式落地實施。隨著醫(yī)療器械注冊人制度試點的推廣, CDMO平臺應運而生(CDMO:即Contract Development Manufacture Organization 醫(yī)療器械合同研發(fā)生產(chǎn)組織,是一種新興外包服務模式,主要接受醫(yī)療器械注冊申請人的委托,為其提供生產(chǎn)工藝的的開發(fā)和改進以及臨床試驗和商業(yè)化銷售所用原輔料、管理、生產(chǎn)的生產(chǎn)供應服務)。
? 注冊人制度的好處 / Benefits of the registrant system
?醫(yī)療器械注冊人制度試點,目的在于進一步探索建立醫(yī)療器械注冊人制度以及委托生產(chǎn)管理制度,優(yōu)化資源配置,落實主體責任;探索建立完善的注冊人醫(yī)療器械質量管理體系,明確醫(yī)療器械注冊人、受托人等主體之間的法律關系,在責任清晰、風險可控的基礎上,構建注冊人全生命周期質量管理制度和體系;探索創(chuàng)新醫(yī)療器械監(jiān)管方式,有效落實“監(jiān)管工作一定要跟上”的要求,進一步釋放產(chǎn)業(yè)活力,推動醫(yī)療器械產(chǎn)業(yè)高質量發(fā)展,滿足人民群眾使用高水平醫(yī)療器械需求。
? 政策扶持 / Policy support
1.在已完成樣品生產(chǎn)的情況下,注冊申請人可向省局提出書面的優(yōu)先審批申請,廣東省食品藥品監(jiān)督管理局對同意納入試點范圍的出具初審意見。廣東省醫(yī)療器械質量監(jiān)督檢驗所依據(jù)廣東省食品藥品監(jiān)督管理局初審意見,對該申請所涉及的產(chǎn)品,優(yōu)先安排檢測。
2.對納入試點的申請人按照《廣東省第二類醫(yī)療器械優(yōu)先審批程序(試行)》,加大技術指導和服務力度,實施優(yōu)先審批。
3.對申請第三類醫(yī)療器械參加試點工作的,由專人負責與國家食品藥品監(jiān)督管理總局對接,進行審評審批。
4. 推進保險制度并對保險進行補貼,對ISO13485認證進行補貼等
5.其它的優(yōu)惠措施正在推出當中。
? 辦理流程 / Processing process
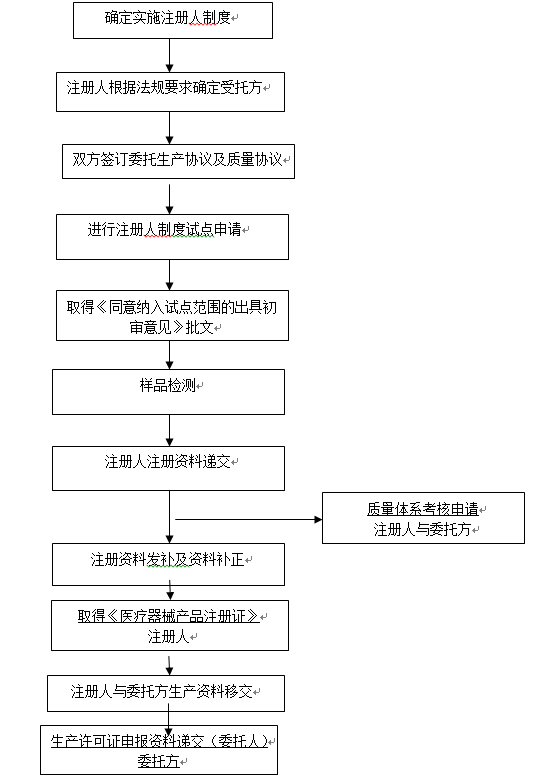
? 生產(chǎn)許可證流程 / Production license process
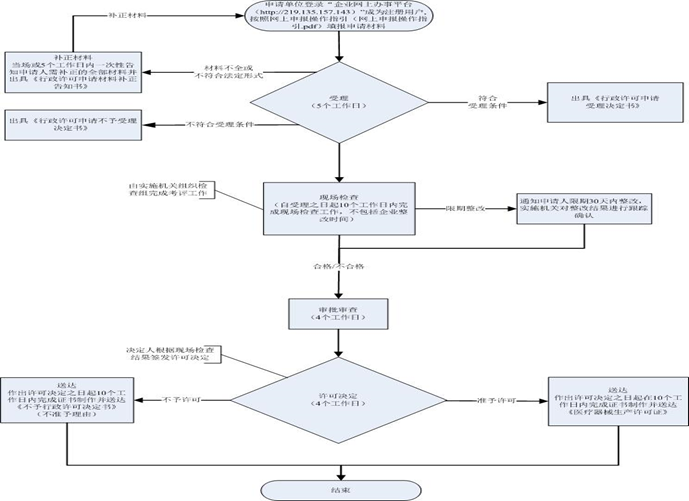
? 注冊人制度試點與現(xiàn)行醫(yī)療器械注冊的異同 / Similarities and differences between
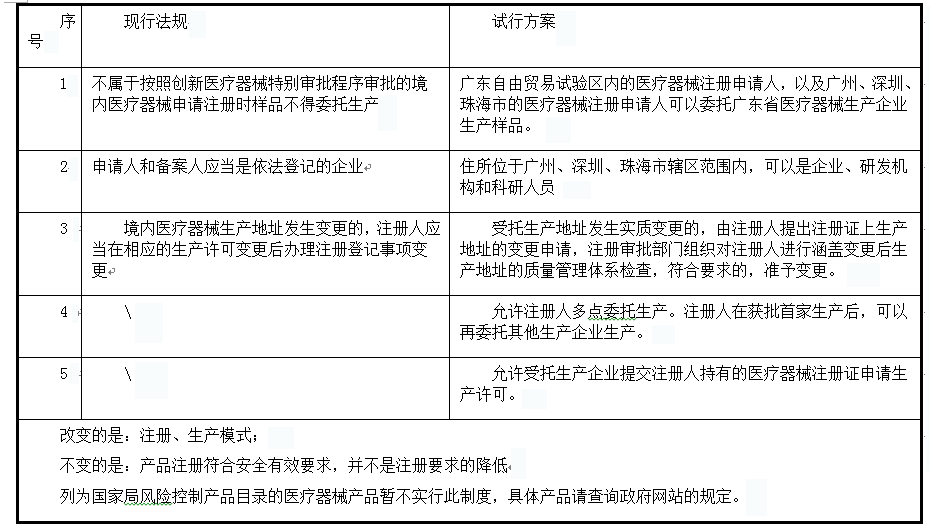
? 辦理依據(jù) / Processing basis
●《關于改革藥品醫(yī)療器械審評審批制度的意見》
●《關于印發(fā)藥品上市許可持有人制度試點方案的通知》
●《中國(上海)自由貿(mào)易試驗區(qū)內醫(yī)療器械注冊人制度試點工作實施方案》
●《廣東省醫(yī)療器械注冊人制度試點工作方案》
? 金飛鷹相關服務 / Golden Eagle related services
●協(xié)助實施注冊人制度的企業(yè)確定合規(guī)的委托方;
●注冊人制度試點申請及現(xiàn)場答辯資料準備;
●申請人樣品檢測準備及檢測進度跟蹤
●注冊人與委托方加工協(xié)議、質量協(xié)議、轉移的技術資料完整性檢查;
●注冊人商業(yè)保險辦理協(xié)助;
●產(chǎn)品注冊全程技術服務;
●注冊申請人、委托方質量體系考核輔導;
●委托方生產(chǎn)許可證全程輔導
全面解決您的研發(fā)、生產(chǎn)、驗收、營銷全流程問題

practical experience
2000多個二、三類醫(yī)械項目經(jīng)驗沉淀,為你分配做過相同案例的實戰(zhàn)老師。
Professional translation
匯聚7大語種專業(yè)翻譯精英,多年醫(yī)械行業(yè)翻譯經(jīng)驗,能準確翻譯專業(yè)名詞及用語。
Software development
強大的軟件研發(fā)團隊,已為集團研發(fā)出成熟的項目管理軟件,可提供軟件定制服務。
Group supply chain
嚴選數(shù)十個優(yōu)秀的醫(yī)械行業(yè)服務機構,可為客戶推薦更實惠的醫(yī)械配套服務。
多次創(chuàng)造二三類高風險產(chǎn)品一次性通過的行業(yè)紀錄
項目狀態(tài):已結案
項目輔導老師:李老師
項目狀態(tài):已結案
項目輔導老師:車老師
項目狀態(tài):已結案
項目輔導老師:王老師
項目狀態(tài):已結案
項目輔導老師:黃老師